浙江省中药配方颗粒质量标准制定规程(试行)
为落实《国家药监局国家中医药局国家卫生健康委国家医保局关于结束中药配方颗粒试点工作的公告》(2021年第22号)要求,加强浙江省中药配方颗粒质量标准管理,省局组织制定了《浙江省中药配方颗粒质量标准制定规程》(试行),现予发布。本规程自发布之日起施行,对施行中遇到的相关问题,请及时反馈省局。
特此通告。
浙江省药品监督管理局
2021年8月16日
浙江省中药配方颗粒质量标准制定规程(试行)
为加强浙江省中药配方颗粒质量标准的管理,规范中药配方颗粒质量标准研究、申报和制定工作,根据《中华人民共和国药品管理法》、《国家药监局国家中医药局国家卫生健康委国家医保局关于结束中药配方颗粒试点工作的公告》(2021年第22号)、《国家药监局关于发布<中药配方颗粒质量控制与标准制定技术要求>的通告》(2021年第16号)(以下简称2021年第16号通告)、《国家药典委员会有关中药配方颗粒药品标准制定的通知》等要求,结合本省实际,制定本规程。
一、适用范围
(一)申报单位
鼓励本省辖区药品生产企业申报或与有中药配方颗粒研究基础的单位联合申报。
(二)品种范围
1.中药配方颗粒品种应符合国家药监局2021年第16号通告要求。
2.中药配方颗粒原则上应为现行版《中国药典》等国家药品标准或《浙江省中药材标准》《浙江省中药炮制规范》等收载品种制成。
3.中药配方颗粒国家标准已颁布的,不再收载。
二、工作程序
(一)立项
申报单位向省食品药品检验研究院(以下简称食药检院)
提交中药配方颗粒质量标准研究立项申请,提交申报表、质量标准草案(一式一份)。食药检院收到资料后5日内按照适用范围要求对立项资料进行形式审查,并将立项申请的基本信息及形式审查结果在食药检院网站上公示。目前我省科研立项已开展中药配方颗粒质量标准研究的品种详见附件1。
(二)标准申报
申报单位按照国家药监局2021年第16号通告要求开展标准研究,按本程序申报资料要求(详见附件2)整理申报资料,向食药检院提出申请,并提交申报资料(含两份纸质版和一套电子版)。
食药检院对资料进行形式审查,资料齐全、规范的,予以接收,并开具标准复核检验送样单(除已完成标准复核检验的品种外)。必要时,可组织对标准研究现场进行核查。
(三)复核检验
申报单位凭标准复核检验送样单,送至少三批样品、必要的其他样品、申报资料至食药检院指定的药品检验机构。药品检验机构收到申报资料和样品后,50日内完成标准复核及样品检验。
(四)技术审核
食药检院40日内组织专家对申报资料进行技术审核。经审核,对需要补充研究的,食药检院原则上提出一次补充资料要求,列明全部问题、补充要求和时限,以书面方式通知申报单位。申报单位一次性按要求提交全部补充资料,补充资料时间不计入技术审核时限;逾期提交的,视为自动放弃标准申报。通过审核的标准,食药检院将申报表、中药配方颗粒质量标准、审核意见报省局。
(五)标准公示
省局将中药配方颗粒质量标准在省局政务网上公示征求意见,公示时间不少于15日。食药检院根据征求意见完善标准,并将中药配方颗粒质量标准正文及其编制说明报省局。
(六)核准发布
省局进行合规性审核,审核通过后以通告形式发布并在省局政务网上公开。
(七)标准备案
标准发布后30日内,省局将标准发布文件、标准文本、编制说明报国家药典委员会备案。
三、标准管理
(一)本省颁布的每个中药配方颗粒质量标准赋予一个标准编号,标准编号格式为:浙PF+四位顺序号+四位年号。标准变更的,在首次标准编号后加四位变更年号。
(二)本省中药配方颗粒质量标准颁布实施后,标准申报单位、使用单位应当定期进行标准适用性评估,根据评估情况及时提出修订标准。
(三)中药配方颗粒国家标准颁布实施后,本省相应的中药配方颗粒质量标准废止。除特殊情况外,给予6个月的执行标准过渡期。
(四)对不适合继续收载或不符合收载范围的中药配方颗粒质量标准,经评估,省局发文废止。
(五)食药检院应当建立标准技术审核的管理体系和中药配方颗粒专家库,完善相关工作制度,依法依技术要求开展审核,确保审核结果科学、公平、公正。
附件:1.本省科研立项已开展研究的中药配方颗粒品种名单
2.申报资料目录及要求
3.中药配方颗粒质量标准申报表
4.基本情况撰写要求
附件1 本省科研立项已开展研究的中药配方颗粒品种名单
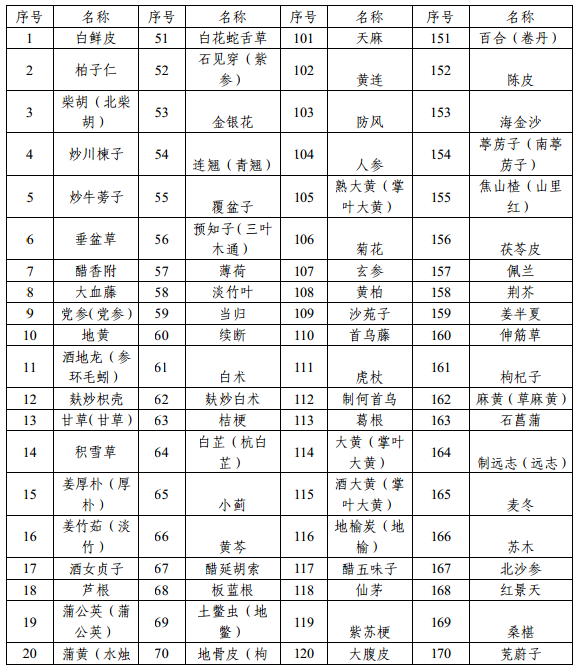
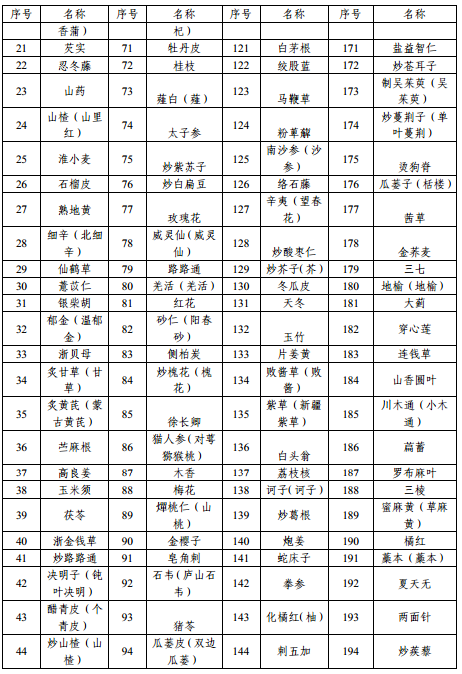
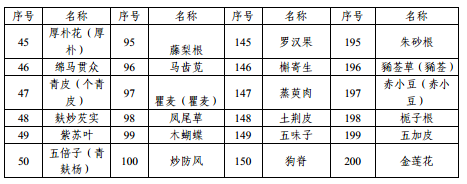
附件2 申报资料目录及要求
资料一、中药配方颗粒质量标准申报表
资料二、研究资料部分
资料1.基本情况
资料2.原料研究资料
资料3.辅料研究资料
资料4.标准汤剂研究资料
资料5.生产工艺研究资料
资料6.与质量相关的研究资料
资料7.质量标准研究资料
资料8.稳定性研究资料
资料9.样品检验报告书
资料10.药包材研究资料
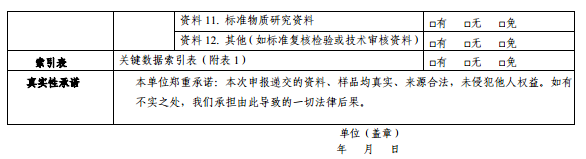
资料11.标准物质研究资料
资料12.其他(如标准复核检验或技术审核资料)
编制要求如下:
资料一、申报表按附件3编制。
资料二、研究资料部分按以下要求编制。
资料1按附件4撰写。
资料2-10按照国家药典委员会《有关中药配方颗粒药品标准制定的通知》附件1中药配方颗粒国家标准申报资料目录及要求进行整理。
资料11列明上述研究中使用标准物质的名称、生产单位、说明书、批号等信息。
中药配方颗粒质量标准中使用的标准物质,如使用非国家药品标准物质的,申请标准复核(或审核)时,还应参照国家药品标准物质研制技术要求,提供新增标准物质研制、标定等资料和实物样品。
资料12复核资料按《国家药监局关于发布<中药配方颗粒质量控制与标准制定技术要求>的通告》(2021年第16号)》中“标准复核技术要求”提供。
附件3中药配方颗粒质量标准申报表

附件4 基本情况撰写要求
一、概况
简述企业基本情况、中药配方颗粒研究总体情况、申报单位成品配方颗粒的生产与销售历史、同品种的国家标准或地方标准发布情况、标准复核检验及技术审核情况、相关专利等。
二、证明文件
提供以下资料:
(一)多家企业联合申报的,提供合作研究协议复印件以及相关研究项目责任分工。
(二)申报单位营业执照、《药品生产许可证》及其变更的批件复印件(如生产场地、生产单位等)。
(三)辅料、包装材料执行标准复印件、登记证明。
(四)非本省的中药配方颗粒质量标准颁布文件、标准正文、起草说明及备案证明复印件(如有)。
三、研究资料综述
(一)原辅料研究情况
1.原料研究资料
1.1中药材
简述基本情况,包括:
(1)道地产区与主产区情况,自建种植(养殖)基地情况。
(2)中药材标准收载的植物来源,包括基源情况。
(3)研究用中药材样品情况,包括基源、药用部位、采收、产地加工、产地(地级市)、批次数量、贮藏方法等。
1.2饮片
简述炮制方法及工艺参数、执行标准等。
1.3内控标准
(1)简述药材/饮片内控标准是否高于法定标准要求,如增加了检测项目或制定了严于法定标准的检测限度,简述新增项目或限度研究基本情况。
(2)简述安全性指标研究情况。
2.辅料研究资料
2.1辅料来源
简述辅料名称、级别、用途、生产企业、登记号等。
2.2辅料质量标准
简述辅料执行标准及标准号。
(二)标准汤剂研究情况
1.制备工艺
简述制备方法,如饮片前处理、每煎饮片量、浸泡时间、煎煮次数、加水量、煎煮时间、浓缩方法和温度、干燥方法等。涉及提取挥发油的,还应说明提取方法和提取量或提取时间等。
2.参数表征
2.1出膏率
以表格形式列出各批次标准汤浸膏得率及标准偏差,表述均值加减3倍SD(或均值的70%—130%)出膏率的允许范围,评价标准汤出膏率实测值。
2.2有效(或指标)成份的含量及含量转移率简述测定方法及测定指标,以表格形式列举测得各批次标准汤剂中有效(或指标)成份的含量,计算转移率和标准偏差。表述转移率均值加减3倍SD(或均值的70%—130%)数值,及相应有效(或指标)成份的含量范围。
2.3特征图谱/指纹图谱
简述采用的方法、确定指纹峰个数及其依据、判定标准(如
相对保留时间、相似度等)等。
(三)配方颗粒研究情况
1.生产工艺研究
1.1生产工艺概述
(1)简述处方(饮片名、投料量)、前处理(如切制、破碎等)、提取方法、温度、加水量、提取次数、浓缩方法(包括温度、真空度等)、辅料组成(包括种类及用量)、制成总量及规格。如浓缩、干燥中加入辅料的,简述加入辅料种类和用量范围。
(2)简述成型工艺研究内容,包括辅料选择、处方筛选、制粒方法、干燥方法、技术参数、包装材料等;简述辅料与中间体(以干燥品计)的比值。
1.2中间体研究
(1)中间体出膏率实测值与标准汤剂出膏率对比研究结果。
(2)中间体有效(或指标)成份的含量与标准汤剂对比研究结果。
(3)中间体特征图谱/指纹图谱与标准汤剂对比研究结果。
(4)中间体内控标准项目简述。
(5)中间体中含辅料的,简述中间体中辅料种类、用量。
1.3生产试验研究
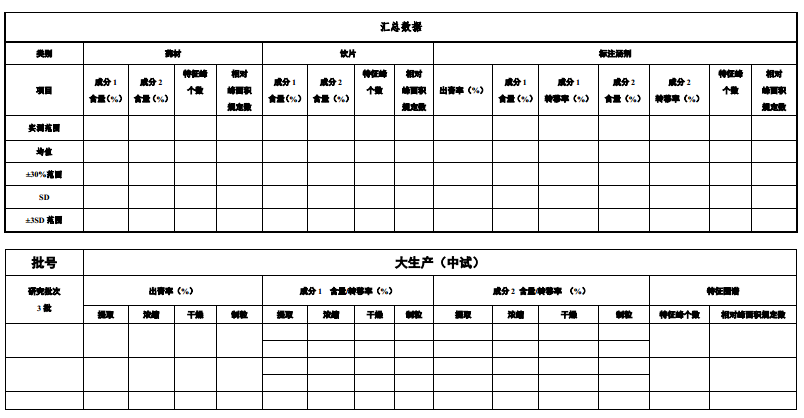
简述至少3批以上生产规模试验或验证批次数据,评价得膏率、含量指标、特征图谱/指纹图谱与标准汤的一致性。
1.4量值传递
以出膏率、含量及含量转移率、指纹图谱或特征图谱、浸出物等的值为表征,简述生产全过程的量值传递情况,设定可接受的偏差范围及理由,从原料到中间体到成品生产全过程的量值传递应具相关性、可行性和合理性。
2.质量标准研究
简述成品质量标准控制项目、方法和方法学验证结果,说明拟定限度的依据,分析设定的质控项目、限度与原辅料、工艺及稳定性之间的关系,与安全性及有效性的联系。
3.稳定性试验
简述稳定性考察方法及结果。
4.样品检验
简述自检报告与标准复核检验报告情况。如存在差异的,分析原因。
5.直接接触药品的包装材料和容器
提供直接接触药品的包装材料和容器的执行标准、生产企业、登记号等。
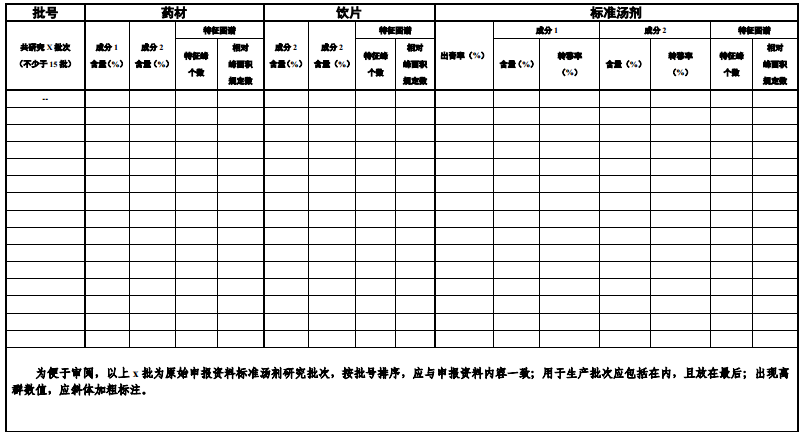
6.汇总量质传递数据表(见附表2)
附表1 关键数据索引表



附表2 量质传递数据汇总表
(参考:《中国药典》2020年版,某饮片规定成分1不得少于..%;成分2不得少于..%,
,有效数位同标准限度)
(文章来源:浙江省药品监督管理局)
生意社商品站
企业动态
- 连翘商品报价动态(2024-04-23)
- 04-23
- 麦冬商品报价动态(2024-04-23)
- 04-23
- 黄芪商品报价动态(2024-04-23)
- 04-23
- 三七商品报价动态(2024-04-23)
- 04-23
- 当归商品报价动态(2024-04-23)
- 04-23
- 枸杞商品报价动态(2024-04-23)
- 04-23
- 金银花商品报价动态(2024-04-23)
- 04-23
- 党参商品报价动态(2024-04-23)
- 04-23
国内动态
- 云南文山三七可供货源较丰 货源走动略有转缓
- 04-23
- 亳州市场:青翘市场货源走销不及前期畅快
- 04-23
- 岷县市场:党参成交货源不多 整体交易平缓
- 04-23
- 岷县市场:黄芪黄芪上货量大 整体走货稳定
- 04-23
- 岷县市场:当归成交货源不多 成交价格疲软
- 04-23
- 亳州市场:山麦冬产新期间人气高 行情坚挺
- 04-23
- 玉林市场:当归商家按需购进 价格变动有限
- 04-23
国际动态
- 中国枸杞输欧盟破壁克垒取得新突破
- 06-23
- 连花清瘟海外版图扩大 获肯尼亚注册批文
- 03-17
- 罗马尼亚千家农户种植中国枸杞
- 02-07
- 美国草药药典《枸杞子》中文版出版
- 02-03
- 韩国对中国产山茱萸和枸杞实施召回
- 12-04
- 连花清瘟获毛里求斯“中成药”注册批文
- 09-22





 浙公网安备 33010002000024号
浙公网安备 33010002000024号